規制対応と開発情報をシステムで効率的に管理
高度な安全性・品質を求められる一方で、多様な製品バリエーション対応など、増大する開発情報は人間の手作業での管理が非常に困難になってきています。医療機器開発業界向けのFDAテンプレートを活用したPLMの導入で情報管理効率を促進させることができます。
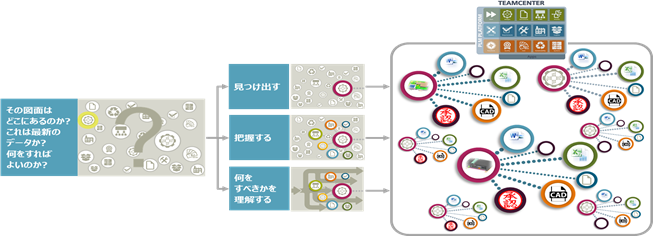
PLM(Product Lifecycle Management)とは、製品開発における企画から保守に至るまでの製品ライフサイクルにおける一連の情報を一元管理し、その情報を活用することによって業務効率・製品品質を担保する考え方です。 派生製品が多い製品にも対応することが可能で、関連情報を即座に探し出すことはもちろん、 成果物の進捗ステータスの見える化、承認データの書き込み保護などを行うことができるようになります。
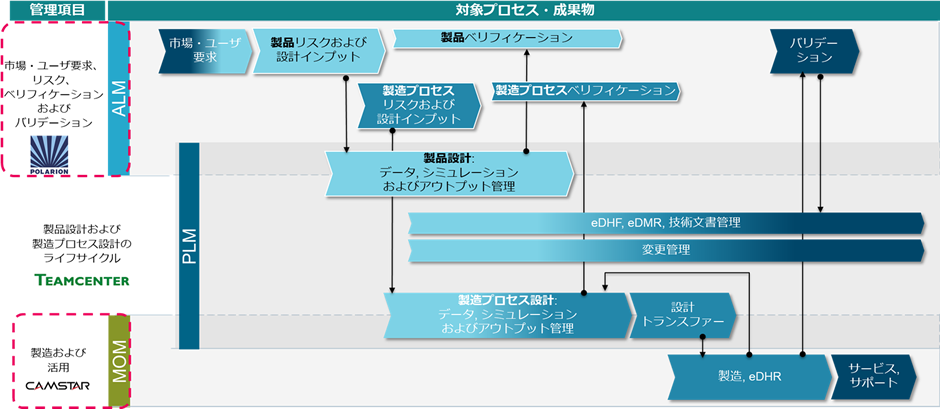
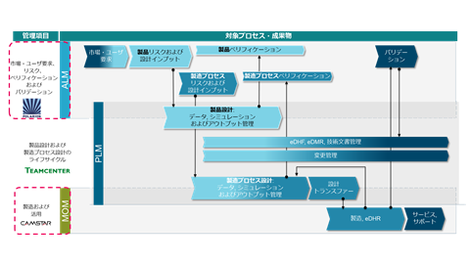
安全性・信頼性が求められる医療機器向けソフトウェア開発では、規制要件や仕様・検証結果の間のトレーサビリティを管理する必要があります。外部監査での必要データの検索の仕組みや、米国FDAと規格策定に参画したベンダーが作成した医療機器開発業界向けのFDAテンプレートが提供されています。これらのソフトウェア開発におけるライフサイクル管理の考え方であるALM(Applcation Lifecycle Management)とPLM領域については、医療機器業界ではシーメンスソリューションが数多く採用されています。
製造現場における進捗や履歴情報、品質情報を管理するMES(Manufacuring Execution System)についても、シーメンスソリューションであれば、医療機器要件に準拠したMESであるため、医療機器製造で求められる高度なトレーサビリティ要件、電子証跡要件を保証できます。